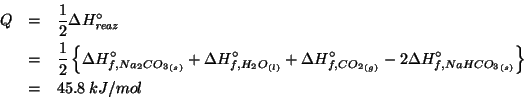Calcolare il ![]() di una soluzione di cinnamato di sodio
di una soluzione di cinnamato di sodio
![]() , sale di un acido debole monobasico, dai seguenti
dati.
, sale di un acido debole monobasico, dai seguenti
dati.
Dati:

Altri simboli:
| molalita' della soluzione di cinnamato sodico | |
| numero di moli di cinnamato sodico | |
| volume della soluzione di cinnamato sodico in |
|
| massa della soluzione di cinnamato sodico in |
|
| massa d'acqua contenuta nella soluzione di cinnamato sodico in |
|
| massa di sale contenuto nella soluzione di cinnamato sodico in |
|
| massa di sale contenuto nella soluzione di cinnamato
sodico in |
|
| concentrazione molare di cinnamato sodico | |
| massa molare del cinnamato sodico: |
|
| costante di idrolisi dello ione cinnamato | |
| costante di ionizzazione dell'acido cinnamico | |
| costante di autoionizzazione dell'acqua:
|
Siccome il cinnamato di sodio (che per brevita' indicheremo con
![]() ) e' il sale di un acido debole monoprotico, il
) e' il sale di un acido debole monoprotico, il ![]() di una
sua soluzione sara' basico a causa dell'idrolisi dell'anione
di una
sua soluzione sara' basico a causa dell'idrolisi dell'anione ![]() :
:
Per analizzare l'equilibrio appena scritto dobbiamo conoscere la
concentrazione iniziale di ![]() (che coincide con quella di
(che coincide con quella di
![]() , poiche' quest'ultimo e' un elettrolita forte) e la costante
di equilibrio. E' facile verificare che la costante di equilibrio e'
data da:
, poiche' quest'ultimo e' un elettrolita forte) e la costante
di equilibrio. E' facile verificare che la costante di equilibrio e'
data da:
per cui dobbiamo trovare ![]() .
.
La concentrazione iniziale di sale si ricava dai dati relativi all'abbassamento crioscopico. A questo proposito va osservato che il cinnamato sodico e' un elettrolita forte e quindi si dissocia completamente secondo:
Questo significa che la molalita' da usare nell'espressione dell'abbassamento crioscopico (la cosiddetta ``molalita' colligativa'') e' doppia rispetto alla molalita' del sale. In termini matematici:

Ora si deve trasformare la molalita' ![]() nella molarita' iniziale
del sale
nella molarita' iniziale
del sale ![]() .
.
Per definizione:
Il volume della soluzione si puo' esprimere in funzione della massa e della densita':

Dividendo numeratore e denominatore per ![]() :
:
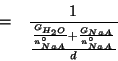
Il primo addendo al denominatore e' proprio l'inverso della
molalita'. Il secondo addendo e' ``quasi'' la massa molare del
sale. Il ``quasi'' e' dovuto al fatto che ![]() e' la massa di
sale in
e' la massa di
sale in ![]() , mentre la massa molare che siamo abituati a
usare e' espressa in
, mentre la massa molare che siamo abituati a
usare e' espressa in ![]() e quindi richiede la massa in
e quindi richiede la massa in
![]() . Chiaramente, vale:
. Chiaramente, vale:
![]() , e quindi:
, e quindi:
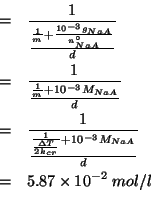
Il primo requisito (la concentrazione iniziale del sale) per il trattamento dell'equilibrio di idrolisi e' stato cosi' ottenuto.
L'altra cosa che ci serve e' la costante di ionizzazione dell'acido
cinnamico ![]() . Per trovarla, utilizziamo la seconda informazione
che ci viene data, e cioe' quella relativa al
. Per trovarla, utilizziamo la seconda informazione
che ci viene data, e cioe' quella relativa al ![]() di una soluzione
dell'acido di concentrazione iniziale nota.
di una soluzione
dell'acido di concentrazione iniziale nota.
Impostiamo il consueto trattamento dell'equilibrio di ionizzazione:
![\begin{displaymath}
\begin{array}{lllll}
&HA &\stackrel{K_{HA}}{=}& A^-&+H^+\\
...
...\left[H^+\right]&&\left[H^+\right]&\left[H^+\right]
\end{array}\end{displaymath}](img39.gif)
La legge dell'azione di massa e':
Osservate che la concentrazione di equilibrio degli ioni idrogeno
e' nota, essendo legata al ![]() dato nel testo.
dato nel testo.
Quindi:
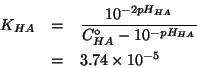
Abbiamo ora tutto cio' che ci serve per trattare l'equilibrio di idrolisi che costituisce l'obiettivo dell'esercizio.
![\begin{displaymath}
\begin{array}{llllll}
&A^-&+H_2O&\stackrel{K_{i}}{=}& AH&+OH...
...t[OH^-\right]&&&\left[OH^-\right]&\left[OH^-\right]
\end{array}\end{displaymath}](img42.gif)
Scriviamo la legge dell'azione di massa, esprimendo la costante di equilibrio in termini della costante di ionizzazione trovata prima:
![\begin{eqnarray*}
\frac{K_W}{K_{HA}}&=&\frac{\left[OH^-\right]^2}{\left[A^-\righ...
...=&\frac{\left[OH^-\right]^2}{C^\circ_{NaA}-\left[OH^-\right]}\\
\end{eqnarray*}](img43.gif)
L'equazione puo'essere risolta cosi' com'e'. Tuttavia, possiamo
osservare che ![]() e' dell'ordine di
e' dell'ordine di ![]() . Cio'
significa che in prima approssimazione si puo' trascurare la frazione
di cinnamato che idrolizza.
. Cio'
significa che in prima approssimazione si puo' trascurare la frazione
di cinnamato che idrolizza.
In termini matematici:
![\begin{eqnarray*}
\frac{K_W}{K_{HA}}\rightarrow0&\Rightarrow&\left[OH^-\right]\l...
...htarrow&C^\circ_{NaA}-\left[OH^-\right]\approx{}C^\circ_{NaA}\\
\end{eqnarray*}](img46.gif)
Quindi:
![\begin{eqnarray*}
\frac{K_W}{K_{HA}}&\approx&\frac{\left[OH^-\right]^2}{C^\circ_{NaA}}\\
\end{eqnarray*}](img47.gif)
da cui:
![\begin{eqnarray*}
\left[OH^-\right]^2&\approx&C^\circ_{NaA}\frac{K_W}{K_{HA}}\\ ...
...c{K_W}{\sqrt{C^\circ_{NaA}\frac{K_W}{K_{HA}}}}\right)\\
&=&8.60
\end{eqnarray*}](img48.gif)
Utilizzando i formalismi appresi nel corso (formule di Lewis, teoria VSEPR, teoria del legame di valenza) descrivere il legame e la geometria nelle seguenti meolecole o ioni:
Cominciamo a scrivere la formula di Lewis.
| Elettroni di valenza | |
| carica | 1 |
| totale | |
L'unica struttura di Lewis ragionevole e':
![\begin{displaymath}
\left[
\begin{xy}
<1em,0em>:
c*+{I};p=''center'',
p+/l3em/*...
...r{\vert},
p+/dl0.1em/**\dir{}?<*\dir{\vert},
\end{xy}\right]^-
\end{displaymath}](img58.gif)
| Determinazione della geometria con la teoria VSEPR | |
| coppie strutturali | 6 |
| geometria delle coppie strutturali | ottaedrica |
| modello |
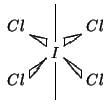 |
| coppie di non legame | 2 |
| geometria molecolare | planare quadrata |
Osserviamo che, siccome le coppie solitarie sono ``piu' repulsive''
delle coppie di legame, le due coppie di non legame si sistemano da
parti opposte del piano formato dagli atomi di ![]() .
.
Dalla geometria delle coppie strutturali ricavata si deduce che
l'ibridazione dell'atomo centrale deve essere di tipo
![]() . Nella formula di Lewis l'atomo di
. Nella formula di Lewis l'atomo di ![]() possiede
possiede ![]() elettroni di valenza mentre ciascun atomo di
elettroni di valenza mentre ciascun atomo di ![]() ne
possiede
ne
possiede ![]() . Ne risulta lo schema di sovrapposizione seguente.
. Ne risulta lo schema di sovrapposizione seguente.
![\begin{psfrags}\psfrag{I} [c][c]{I}\psfrag{Cl} [c][c]{Cl}\psfrag{s} [c][c]...
...}}\psfrag{d2sp3} [c][c]{{$d^2sp^3$}}
\includegraphics{icl4-.eps}
\end{psfrags}](img62.gif)
Formula di Lewis.
| Elettroni di valenza | |
| carica | -1 |
| totale | |
Possibili formule di Lewis:
![\begin{displaymath}
\begin{array}{cc}
\left[
\begin{xy}
<1em,0em>:
c*+{P};
p+/l...
...*\dir{\vert},
\end{xy}\right]^+
\\
&\\
(A)&(B)\\
\end{array}\end{displaymath}](img66.gif)
La struttura ![]() (e le tre strutture di risonanza ad essa
equivalenti, non mostrate per brevita') e' meno stabile della
struttura
(e le tre strutture di risonanza ad essa
equivalenti, non mostrate per brevita') e' meno stabile della
struttura ![]() poiche' prevede una carica atomica formale pari a
poiche' prevede una carica atomica formale pari a
![]() sull'atomo di
sull'atomo di ![]() legato con doppio legame.
legato con doppio legame.
| Determinazione della geometria con la teoria VSEPR | |
| coppie strutturali | 4 |
| geometria delle coppie strutturali | tetraedrica |
| modello |
 |
| coppie di non legame | 0 |
| geometria molecolare | tetraedrica |
Dalla geometria delle coppie strutturali ricavata si deduce che
l'ibridazione dell'atomo centrale deve essere di tipo
![]() . Nella formula di Lewis piu' stabile (la
. Nella formula di Lewis piu' stabile (la ![]() ) l'atomo di
) l'atomo di ![]() possiede
possiede ![]() elettroni di valenza mentre ciascun atomo di
elettroni di valenza mentre ciascun atomo di ![]() ne
possiede
ne
possiede ![]() . Ne risulta lo schema di sovrapposizione seguente.
. Ne risulta lo schema di sovrapposizione seguente.
![\begin{psfrags}\psfrag{P} [c][c]{P}\psfrag{Cl} [c][c]{Cl}\psfrag{s} [c][c]...
...igma$}}\psfrag{sp3} [c][c]{{$sp^3$}}
\includegraphics{pcl4+.eps}
\end{psfrags}](img73.gif)
Formula di Lewis.
| Elettroni di valenza | |
| totale | |
Possibili formule di Lewis:

La struttura ![]() (e la struttura di risonanza ad essa
equivalente, non mostrata per brevita') e' meno stabile della
struttura
(e la struttura di risonanza ad essa
equivalente, non mostrata per brevita') e' meno stabile della
struttura ![]() poiche', diversamente da questa, prevede cariche
atomiche formali non nulle (
poiche', diversamente da questa, prevede cariche
atomiche formali non nulle (![]() e
e ![]() ) sugli atomi di
) sugli atomi di ![]() .
.
| Determinazione della geometria con la teoria VSEPR | |
| coppie strutturali | 2 |
| geometria delle coppie strutturali | lineare |
| modello |
|
| coppie di non legame | 0 |
| geometria molecolare | lineare |
Dalla geometria delle coppie strutturali ricavata si deduce che
l'ibridazione dell'atomo centrale deve essere di tipo
![]() . Nella formula di Lewis piu' stabile (la
. Nella formula di Lewis piu' stabile (la ![]() ) l'atomo di
) l'atomo di ![]() possiede
possiede ![]() elettroni di valenza mentre ciascun atomo di
elettroni di valenza mentre ciascun atomo di ![]() ne
possiede
ne
possiede ![]() . Inoltre, si vede che l'atomo di carbonio forma due
legami di tipo
. Inoltre, si vede che l'atomo di carbonio forma due
legami di tipo ![]() e due legami di tipo
e due legami di tipo ![]() . Ne risulta uno
schema di sovrapposizione identico a quello di
. Ne risulta uno
schema di sovrapposizione identico a quello di ![]() .
.
![\begin{psfrags}\psfrag{C} [c][c]{C}\psfrag{S} [c][c]{S}\psfrag{s} [c][c]{{...
...[c][c]{{$sp$}}\psfrag{p} [c][c]{{$p$}}
\includegraphics{cs2.eps}
\end{psfrags}](img86.gif)
Formula di Lewis.
| Elettroni di valenza | |
| carica | 1 |
| totale | |
Possibili formule di Lewis:
![\begin{displaymath}
\begin{array}{ccc}
\left[
\begin{xy}
c*+{Cl};
p+/u0.1em/**\d...
...{\vert},
\end{xy}\right]^-
\\
&&\\
(A)&(B)&(C)\\
\end{array}\end{displaymath}](img89.gif)
Le strutture ![]() e
e ![]() (fra loro identiche) sono piu' stabili
della struttura
(fra loro identiche) sono piu' stabili
della struttura ![]() , poiche' le cariche atomiche formali sono
minori (osservate che il
, poiche' le cariche atomiche formali sono
minori (osservate che il ![]() puo' avere valenza espansa).
puo' avere valenza espansa).
| Determinazione della geometria con la teoria VSEPR | |
| coppie strutturali | 4 |
| geometria delle coppie strutturali | tetraedrica |
| modello |
 |
| coppie di non legame | 2 |
| geometria molecolare | angolata |
Dalla geometria delle coppie strutturali ricavata si deduce che
l'ibridazione dell'atomo centrale deve essere di tipo
![]() . Nella formula di Lewis piu' stabile (la
. Nella formula di Lewis piu' stabile (la ![]() o la
o la
![]() , e' indifferente) l'atomo di
, e' indifferente) l'atomo di ![]() possiede
possiede ![]() elettroni di valenza; l'atomo di
elettroni di valenza; l'atomo di ![]() legato con
doppio legame ne possiede
legato con
doppio legame ne possiede ![]() mentre l'atomo di
mentre l'atomo di ![]() legato con
legame singolo ne possiede
legato con
legame singolo ne possiede ![]() . Ne risulta uno
schema di sovrapposizione come quello mostrato qui di seguito.
. Ne risulta uno
schema di sovrapposizione come quello mostrato qui di seguito.
![\begin{psfrags}\psfrag{Cl} [c][c]{Cl}\psfrag{O} [c][c]{O}\psfrag{O} [c][c]...
...sfrag{schemaPi} [c][c]{schema {$\pi$}}
\includegraphics{clo2-.eps}
\end{psfrags}](img92.gif)
Calcolare il calore da fornire ad una mole di idrogeno carbonato di sodio per far avvenire la decomposizione seguente in condizioni standard:
I valori dell'entalpia molare standard di formazione per
![]()
![]()
![]() e
e
![]() sono, rispettivamente,
sono, rispettivamente,
![]() ,
,
![]() ,
,
![]() e
e
![]() .
.
Dati:

Altri simboli:
|
|
variazione di entalpia per la reazione in condizioni standard |
Il calore richiesto coincide con la variazione di entalpia
per la reazione nelle condizioni date. Quest'ultima, a sua volta, si
ricava dalle entalpie di formazione dei reagenti e prodotti come visto
durante il corso.
Da notare che il problema richiede il calore da fornire ad una
mole di ![]() : cio' significa che la variazione di entalpia per
la reazione va divisa per 2, poiche' la reazione coinvolge
: cio' significa che la variazione di entalpia per
la reazione va divisa per 2, poiche' la reazione coinvolge ![]() di
di ![]() .
.
Quindi: