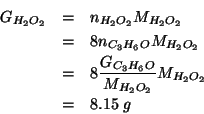![]() di una miscela di zinco e magnesio, bruciati con un eccesso di
aria, formano una miscela dei relativi ossidi che pesa
di una miscela di zinco e magnesio, bruciati con un eccesso di
aria, formano una miscela dei relativi ossidi che pesa
![]() . Determinare la composizione percentuale in massa della
miscela di partenza.
. Determinare la composizione percentuale in massa della
miscela di partenza.
Dati:
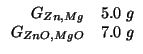
Altri simboli:
| massa di |
|
| massa di |
|
| massa di |
|
| massa di |
|
| massa molare di |
|
| massa molare di |
|
| massa molare di |
|
| massa molare di |
|
| numero di moli di |
|
| numero di moli di |
|
| numero di moli di |
|
| numero di moli di |
|
|
|
percentuale di |
|
|
percentuale di |
In base ai dati del problema possiamo iniziare a scrivere:
e
Siccome si richiede la composizione della miscela, dobbiamo trovare
![]() e
e ![]() . La prima relazione lega direttamente queste
due incognite. Ci serve pero' una seconda relazione indipendente: la
seconda equazione su scritta serve allo scopo. Infatti essa puo'
essere espressa in termini di
. La prima relazione lega direttamente queste
due incognite. Ci serve pero' una seconda relazione indipendente: la
seconda equazione su scritta serve allo scopo. Infatti essa puo'
essere espressa in termini di ![]() e
e ![]() basandoci sulle
seguenti considerazioni.
basandoci sulle
seguenti considerazioni.
Innanzitutto, esprimiamo le masse dei due ossidi in termini delle rispettive masse molari e del numero di moli:
Ora, data la formula dei due ossidi e il fatto che la miscela e' stata bruciata in eccesso di ossigeno, possiamo certamente dire che il numero di moli di ciascun ossido deve essere lo stesso del corrispondente elemento nella miscela. Quindi:
Ma le moli dei due elementi possono ora essere espresse proprio in termini delle loro masse, portando a:
Abbiamo cosi' ottenuto la seconda relazione che lega le due incognite.
Riscriviamo le due equazioni per maggior chiarezza:

Non resta che risolvere il sistema.
Sottraendo dalla prima la seconda moltiplicata per
![]() si ottiene:
si ottiene:
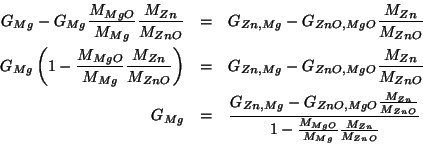
Moltiplicando ambo i membri per
![]() si ottiene
direttamente la percentuale di
si ottiene
direttamente la percentuale di ![]() nella miscela:
nella miscela:
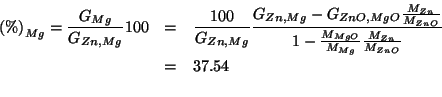
Chiaramente:
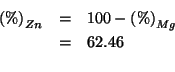
Si hanno ![]() di una soluzione di un generico acido forte
di una soluzione di un generico acido forte
![]() in concentrazione
in concentrazione ![]() . Calcolare il valore del
. Calcolare il valore del
![]() quando si aggiunge un volume di una soluzione di ammoniaca
quando si aggiunge un volume di una soluzione di ammoniaca
![]() :
:
(
![]() )
)
Dati:
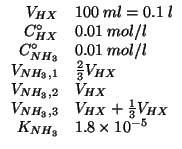
Altri simboli:
| costante di autoionizzazione dell'acqua:
|
Come osservazione preliminare, consideriamo la reazione che si verifica all'atto dell'aggiunta dell'ammoniaca:
La costante di equilibrio ![]() di questa reazione si esprime
facilmente in termini di dati del problema:
di questa reazione si esprime
facilmente in termini di dati del problema:
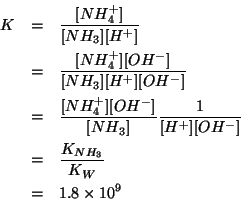
Dal valore di ![]() si deduce che la reazione si puo' considerare
completa.
si deduce che la reazione si puo' considerare
completa.
Dopo la reazione rimarranno ioni idronio non reagiti in concentrazione pari a:
Le concentrazioni iniziali da considerare non sono quelle date nel testo dell'esercizio, ma si deve tenere conto della diluizione dovuta al mescolamento delle due soluzioni. Quindi:
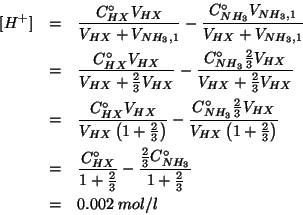
e:
Il risultato e' ragionevole. Infatti, il ![]() e' aumentato rispetto
al valore iniziale in presenza del solo acido
(
e' aumentato rispetto
al valore iniziale in presenza del solo acido
(
![]() ): questo e' cio' che
ci aspettiamo in seguito all'aggiunta di una base.
): questo e' cio' che
ci aspettiamo in seguito all'aggiunta di una base.
Impostiamo dunque il consueto trattamento dell'equilibrio, osservando, comunque, che le concentrazioni iniziali di ioni idronio e ammoniaca sono uguali e quindi tali saranno anche i corrispondenti valori di equilibrio:
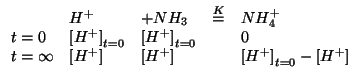
La legge dell'azione di massa e':
Questa equazione puo' essere risolta cosi' com'e'. Tuttavia possiamo semplificarla se osserviamo che, essendo la costante di equilibrio molto grande, la concentrazione di ioni idronio ``sopravvissuti'' all'equilibrio sara' molto piccola in confronto al suo valore iniziale. In sintesi:
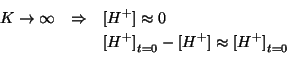
Cosi', la legge dell'azione di massa si semplifica in:
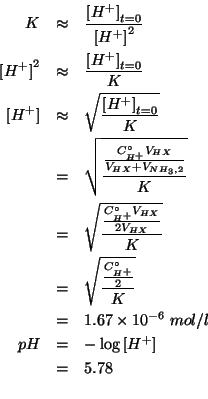
Osserviamo che il valore trovato per
![]() e' tale da
giustificare ampiamente l'approssimazione
e' tale da
giustificare ampiamente l'approssimazione
![]() .
.
La risoluzione di questo punto si poteva anche impostare facendo reagire idealmente l'acido e la base in modo completo costruendo pertanto delle condizioni iniziali equivalenti a quelle date:
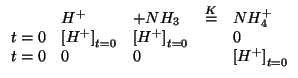
Il sistema cosi' ottenuto e' il ben noto caso della dissociazione di
un acido debole (![]() ) di data concentrazione iniziale (la
reazione procedera' da destra verso sinistra, con costante di
equilibrio pari a
) di data concentrazione iniziale (la
reazione procedera' da destra verso sinistra, con costante di
equilibrio pari a ![]() ). Chiaramente, applicando la nota formula
relativa a questo caso, si ottiene un'espressione identica a quella
ottenuta in precedenza.
). Chiaramente, applicando la nota formula
relativa a questo caso, si ottiene un'espressione identica a quella
ottenuta in precedenza.
Una prima strategia parte dalla seguente considerazione. Se ammettiamo
che la reazione sia completa, allora una parte dell'ammoniaca
(precisamente un numero di moli pari a quello delle moli di acido
inizialmente presenti) verra' trasformata in ione ammonio e una parte
restera' non reagita; dopo la reazione, la soluzione conterra'
pertanto una quantita' apprezzabile di ammoniaca (base) e ione ammonio
(acido coniugato): in altre parole si tratta di una soluzione
tampone. Bastera' allora applicare il noto risultato che fornisce
immediatamente il ![]() di un tampone basico. In definitiva:
di un tampone basico. In definitiva:
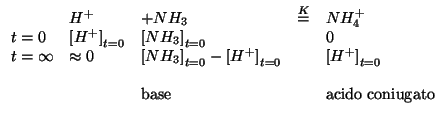
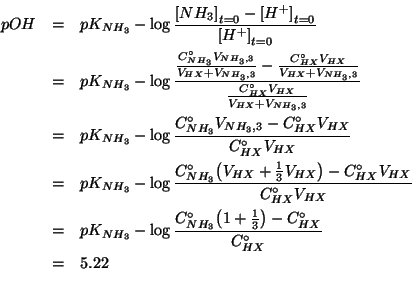
da cui:
Come ci si aspetta (abbiamo aggiunto un eccesso di base), il ![]() trovato e' basico.
trovato e' basico.
Un secondo modo equivalente di procedere consiste nell'impostare la trattazione dell'equilibrio nel modo consueto, sfruttando poi il valore molto grande della costante di equilibrio.
Scegliendo la concentrazione di ioni idronio all'equilibrio come incognita si ha:
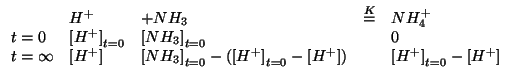
Inseriamo le concentrazioni di equilibrio nella legge dell'azione di massa:
Ora osserviamo che, essendo la costante molto grande, la concentrazione di ioni idronio ``sopravvissuta'' ad equilibrio raggiunto sara' talmente piccola da essere trascurabile rispetto alla concentrazione inizialmente presente. In sintesi:
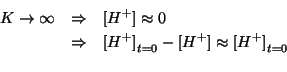
Introducendo questa approssimazione nella legge dell'azione di massa si ottiene:
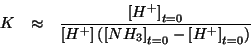
che puo' essere riarrangiata come segue:
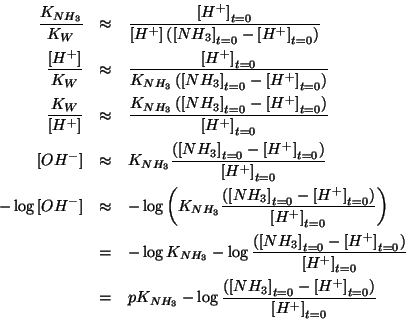
che e' identica all'espressione scritta prima considerando il sistema come una soluzione tampone (e quindi porta al medesimo risultato).
Calcolare quanti grammi di acqua ossigenata (![]() ) sono necessari per
ossidare
) sono necessari per
ossidare ![]() di acetone (
di acetone (![]() ) ad anidride carbonica ed
acqua in ambiente acido. (L'acqua ossigenata si riduce ad acqua).
) ad anidride carbonica ed
acqua in ambiente acido. (L'acqua ossigenata si riduce ad acqua).
Dati:
![]()
Altri simboli:
|
|
massa molare dell'acetone: |
| massa molare dell'acqua ossigenata:
|
|
| numero di moli |
|
| numero di moli |
|
| massa di |
Prima di tutto dobbiamo scrivere l'equazione chimica bilanciata che descrive la reazione. Applicando la procedura vista durante il corso si ha:
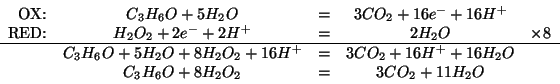
Dall'equazione si vede che il rapporto stechiometrico fra ![]() e
e
![]() e' pari a
e' pari a ![]() . Quindi:
. Quindi: